αリポ酸ラセミ体サプリメントに含まれているS体による死亡率上昇メカニズムを解明!
~糖尿病・脂質異常症の方のαリポ酸ラセミ体摂取は危険!~
αリポ酸(ALA)は、コエンザイムQ10やL-カルニチンと同様に厚生労働省によって2004年に医薬品から区分変更され、食品に利用できるようになった機能性素材であり、糖代謝の促進によるエネルギー産生や抗酸化作用が注目されています。しかしながら、現在、食品機能性素材として利用されているαリポ酸は、生体内でもともと生合成されている天然型のR体(RALA)と非天然型のS体(SALA)を50%ずつ含んでいるラセミ体と呼ばれるものです。医薬品への配合であれば臨床試験に基づく摂取制限があるため、SALAに副作用があってもなんら問題にはなりません。しかし、摂取量の制限ができない食品となると話は違ってきます・・・
まず、これまでに知られているALAラセミ体の安全性について・・・・・
CremerらのALAラセミ体の安全性に関する報告があります。ラット単回投与試験におけるLD50値は2000mg/kg以上、Ames試験でも変異原性は示さない、また、4週間のラット反復投与試験でも無毒性量(NOAEL)は61.9mg/kg/日であると報告されています。さらにCremerらは、ラットに大容量のALAラセミ体(20~180mg/kg)を2年間に渡り、経口投与させても毒性に基づく血中パラメーターや臓器に異常は認められなかったと報告しており、ALAラセミ体の安全性は十分に示されているようにみえます。
しかし、一方でSALAの毒性を問題視する報告も少なくありません・・・・・
Wesselらによると、糖尿病モデルマウスを用いた実験でRALA投与による死亡率低減とSALA投与による死亡率上昇が確認され、糖尿病に対するRALAの治癒効果が示されるとともにSALAの危険性が明らかとされています。
αリポ酸サプリメントに含有するS体の危険性が明らかに
では、前述のSALAを含有するALAラセミ体は安全であるというCremerらの安全性評価とSALA摂取による死亡率上昇というSALAの毒性を示すWesselらによる危険性評価は、はたして、どちらが正しいのでしょうか?・・・・・・・・
結論から言うと、実はどちらも正しい評価であると考えられます。ただ、その違いは健常な動物を使った実験なのか、糖尿病を誘発させた動物を使った実験なのか、ただそれだけでまったく反対の結果となったわけです。
Wesselらの検討が、もしヒト試験であったとしたら(もちろん、ヒトの死亡率評価はできませんが)、そして、同じ結果となるとしたら、恐ろしいと思いませんか??
つまり、ALAラセミ体サプリメントの摂取は健常人にとって健康増進効果はあるものの、糖尿病患者が摂取するとマウスと同様に死亡率が高まることにはならないか・・・・・と。
そこで、私の研究グループは、ALAに関するこれまでの学術論文、総説などの膨大な報告を調査し、ある仮説をたてました・・・・・
天然体のRALAと非天然体のSALAはM光学異性体(鏡像異性体)の関係にあります。鏡像異性体に関しては下記をご参照ください。
鏡像異性体の悲劇とリポ酸(1)
鏡像異性体の悲劇とリポ酸(2)
RLAと同様に生体内に存在している様々なタンパク質も天然のアミノ酸からなる光学異性体ですので、40億年前の生命誕生から今日までの生命体を形成していく過程で、生体に悪影響を及ぼす可能性のある、生体内でのRALAとタンパク質という天然物質同士による非選択的不可逆反応(コラム①参照)は排除されていったであろうと考えられます。しかし、人工的に作り出した非天然体のSALAと天然のタンパク質の非選択的不可逆反応による悪影響は排除されていないのです。
ここでは、我々の研究から導き出した結論を先に述べ、次に、その根拠となる試験を説明していきます。
繰り返しになりますが、Wesselらは糖尿病モデルマウスにSLAを投与すると死亡率が上昇するというSALAの危険性を明らかにしていますが、マウスではなくヒト(糖尿病患者)によるインビボ(生体内)試験はできません。そこで、我々は幾つかのインビトロ(試験管内)試験を行いました。そして、その結果、『糖尿病患者のみならず、血液の粘度が高くなっているメタボリック症候群の方々、脂質異常症や高血圧患者にとっても、LAラセミ体サプリメントを摂取すると、動脈硬化、心筋梗塞、脳梗塞などを招く危険性が高くなる』と結論付けしました。
SALAによる糖尿病モデルマウスの死亡率上昇の機構を解明するため、以下の検討を行いました。
①RALAとSALAの胃液と腸液の溶解度評価
我々は東京理科大と摂南大学との共同研究からALAは胃と小腸の双方から生体吸収されるものと考えています。生体吸収性と溶解度には正の相関がありますので、人工胃液と人工腸液を用いてRALAとSALAの溶解度の差を検討しました。その結果、ここでは詳しいデータは示しませんが、溶解度に有意差はありませんでした。
②RALAとSALAのCaco2細胞による膜透過量と細胞取り込み量の評価(尚、ALAの腸内輸送経路については詳しく検討された論文があります。コラム②をご参照ください。)
ここでは、詳しいデータは示しませんが、トランスポーター仲介経路をとっているRALAとSALAはどちらも時間依存的に細胞透過量が増加し、取り込み量もほぼ同じで、RALAとSALAに有意差はありませんでした。
これらの結果から、RALAとSALAは腸管からの生体吸収性に違いはないと考えられました。その上で、ラットへの単回経口投与による血漿中ALAの濃度変化を検討しました。
③ラットへの単回経口投与による血漿中ALAの濃度変化
(図1)と(図2)に示しますように、同じ量のRALAとSALAを経口投与したにもかかわらず、血漿中濃度はCmax、AUCともに明らかに違いのあることが確かめられました。この検討結果を指示するGroeglerらの論文があります。健常男性15名によるALAラセミ体の単回投与による検討で、ラセミ体(RALAとSALAがそれぞれ50%ずつ)を摂取したにもかかわらず、血漿中のRALAの濃度はSALAの濃度よりも遥かに高いことが示されています。
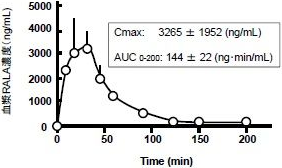
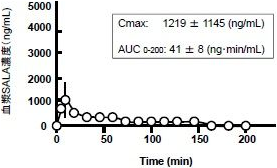
上述の①と②の検討結果に対して、③とGroeglerの検討結果は、一見、矛盾があるようにみえます。しかし、非天然物のSALAと生体内タンパク質の非選択的不可逆反応によるSALAの消失があるとすれば、いずれの検討結果も正しいと判断できます。
つまり、SALAは腸管上皮細胞から吸収されてはいるものの、血液中に送り込まれると、血液中のタンパク質との非選択的で不可逆な反応によって消失するため、血漿中SALA濃度はRALA濃度に比べ、有意に低い結果となった・・・・と。
血中タンパクであるアルブミンをご存知でしょうか?
アルブミンは「血清」に含まれているタンパクの主成分の一つで、血液の浸透圧の保持やビリルビンや遊離脂肪酸などの物質の保持や運搬の役割を持っています。アルブミンは血液中のタンパク質の約7割を占めています。そして、生体内のアルブミンの70%はチオール基をもつ還元型で存在しています。そして、チオール基はALAのジチアン環との共有結合性を有しています。(ここの部分、難しいと思われた方は、単に、ALAとアルブミンは反応しやすい!とだけ、理解してください。)
RALAとSALAが生体内に吸収され、血液中に進入すると、アルブミンと出会うことになります。もともと天然体のRALAは血液中に存在するアルブミンと出会っても、生体機能の維持に不利な反応は排除されているはずですが、非天然体のSALAがアルブミンと出会うと、非選択的不可逆反応を起こし、生体機能維持に悪影響を与えないだろうか?・・・・
この疑問に答えるため、卵由来のアルブミンとヒト由来のアルブミンを用いて、ALAの相互作用(RALAとSALAの濃度変化と不溶性物質生成量の違い)を検討しました・・・・
透明なアルブミン水溶液にRALAとSALAを添加したところ、RALAは完全に溶解しましたが、SALAの場合は大きな不溶物を形成することが判明しました。

そして、その不溶物を分析したところSALAはほとんど検出できませんでした。そして、RALAとSALAは同じ量を添加したにもかかわらず、SALA濃度はRALA濃度よりも有意に低いことが明らかとなりました。この結果は、SALAとアルブミンが非選択的不可逆反応を起こし、不溶性の重合物が生成することを意味しています。
このような反応が血液中で起これば、血液の粘度は高められ、特に動脈硬化の危険性のある患者に悪影響を与えると考えられるのです。また、これまでの学術的な報告の中には、この結果を支持する報告があります。ALAラセミ体をマウスに混餌摂取させた試験の血液性化学検査値において、尿酸やカリウムが有意に上昇したという報告ですが、その考察として“何らかの要因で腎臓に不溶物質が沈着・蓄積し、糸球体の濾過機能に異常がみられる”といったALAラセミ体の腎機能障害の可能性が指摘されています。そういった背景で、我々は今後、腎機能低下モデルマウスを用いてALAラセミ体の危険性についても、さらに追求する予定にしています。
カルニチンはALAと同じように医薬品から区分変更され食品に利用できるようになった機能性素材ですが、鏡像異性体であるD-カルニチンは、非天然物質としての副作用が指摘され、いまでは、ラセミ体のDL-カルニチンではなく、天然体の“L-カルニチン”が一般的に使用されています。同様にALAの場合にもRS-αリポ酸ではなく、天然体の“R-αリポ酸”を一般的に使用すべきだと思います。
以上、ここでは詳しい実験データを省き、なるべく簡潔にまとめるようにしました。これらの内容は、詳しいデータとともに学術論文としてまとめています。
コラム①:非選択的不可逆反応
非選択的反応とは、反応部位を多く含む場合にランダムに進行する反応であり、不可逆反応とは化学反応のうち、正反応のみが起こり、逆反応が起こらないため、一方向にのみ進行する反応です。たとえば、血糖値の高い糖尿病患者にみられるブドウ糖や糖変性物であるメチルグリオキサールなどによる生体内タンパク質の変質は非選択的不可逆反応である糖化反応によるものです。
コラム②:ALAの腸内輸送経路
ALAのような低分子量化合物の腸内輸送に関しては二つの経路があります。その一つはトランスポーターが仲介した細胞内の輸送経路で、もう一つは細胞間結合部の細胞間隙経路です。前者はエネルギー依存活性輸送が関与し、後者は受動拡散です。グルコース、アミノ酸、ジペプチド、水溶性ビタミンなどのような栄養素の腸管吸収はトランスポーター仲介経路により、カルシウムなどのミネラルは細胞間隙経路をとることが知られています。高石らは、腸管上皮のヒト腸管Caco2単層を用いてALAの腸管吸収のメカニズムを調べ、ALAの場合は、トランスポーター仲介経路をとっていることを確かめました。
コラム①:非選択的不可逆反応
非選択的反応とは、反応部位を多く含む場合にランダムに進行する反応であり、不可逆反応とは化学反応のうち、正反応のみが起こり、逆反応が起こらないため、一方向にのみ進行する反応です。たとえば、血糖値の高い糖尿病患者にみられるブドウ糖や糖変性物であるメチルグリオキサールなどによる生体内タンパク質の変質は非選択的不可逆反応である糖化反応によるものです。
コラム②:ALAの腸内輸送経路
ALAのような低分子量化合物の腸内輸送に関しては二つの経路があります。その一つはトランスポーターが仲介した細胞内の輸送経路で、もう一つは細胞間結合部の細胞間隙経路です。前者はエネルギー依存活性輸送が関与し、後者は受動拡散です。グルコース、アミノ酸、ジペプチド、水溶性ビタミンなどのような栄養素の腸管吸収はトランスポーター仲介経路により、カルシウムなどのミネラルは細胞間隙経路をとることが知られています。高石らは、腸管上皮のヒト腸管Caco2単層を用いてALAの腸管吸収のメカニズムを調べ、ALAの場合は、トランスポーター仲介経路をとっていることを確かめました。
